Pytanie, czym jest elektroliza, jest rozważane na szkolnym kursie fizyki i dla większości ludzi nie jest tajemnicą. Inna sprawa to jego znaczenie i praktyczne zastosowanie. Proces ten jest stosowany z wielką korzyścią w różnych gałęziach przemysłu i może być przydatny dla domowego rzemieślnika.
Zawartość
Co to jest elektroliza?
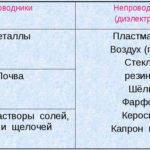
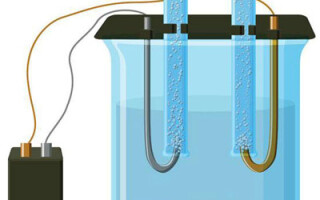
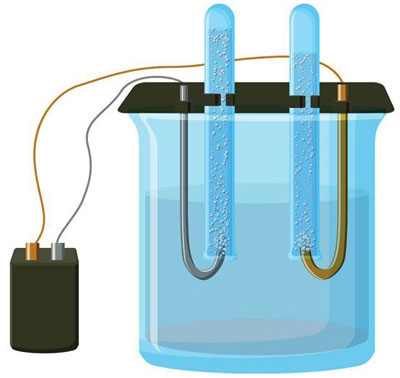
Elektroliza to zespół specyficznych procesów zachodzących w układzie elektrod i elektrolitu, przez który przepływa stały prąd elektryczny. Jego mechanizm opiera się na występowaniu prądu jonowego. Elektrolit jest przewodnikiem typu 2 (przewodnictwo jonowe), w którym zachodzi dysocjacja elektrolityczna. Wiąże się to z rozkładem na jony z dodatnim (kation) i ujemna (anion) opłata.
System elektrolizy koniecznie zawiera dodatni (anoda) i ujemna (katoda) elektroda. Po przyłożeniu stałego prądu elektrycznego kationy zaczynają przemieszczać się w kierunku katody, a aniony w kierunku anody. Kationami są głównie jony metali i wodór, a aniony to tlen, chlor. Na katodzie kationy przyłączają do siebie nadmiar elektronów, co zapewnia zajście reakcji redukcji Men+ + ne → Me (gdzie n jest wartościowością metalu). Na anodzie, przeciwnie, elektron jest oddany z anionu z zachodzącą reakcją utleniania.
W ten sposób w systemie przewidziany jest proces redoks. Ważne jest, aby wziąć pod uwagę, że do jego przepływu potrzebna jest odpowiednia energia. Musi być zapewniony przez zewnętrzne źródło prądu.
Prawa elektrolizy Faradaya
Wielki fizyk M. Faraday swoimi badaniami umożliwił nie tylko zrozumienie natury elektrolizy, ale także dokonanie niezbędnych obliczeń do jej realizacji. W 1832 roku pojawiły się jego prawa, łączące główne parametry toczących się procesów.
Pierwsze prawo
Pierwsze prawo Faradaya mówi, że masa substancji redukowanej na anodzie jest wprost proporcjonalna do ładunku elektrycznego indukowanego w elektrolicie: m = kq = k*I*t, gdzie q to ładunek, k to współczynnik lub ekwiwalent elektrochemiczny substancji, I to siła prądu przepływającego przez elektrolit, t to czas przepływu prądu.

Drugie prawo
Drugie prawo Faradaya umożliwiło wyznaczenie współczynnika proporcjonalności k. Brzmi to tak: elektrochemiczny ekwiwalent dowolnej substancji jest wprost proporcjonalny do jej masy molowej i odwrotnie proporcjonalny do wartościowości. Prawo jest wyrażone jako:

k = 1/F*A/z, gdzie F jest stałą Faradaya, A jest masą molową substancji, z jest jej wartościowością chemiczną.
Biorąc pod uwagę oba prawa, można wyprowadzić ostateczny wzór na obliczenie masy osadzonej na elektrodzie substancji: m = A*I*t/(n*F), gdzie n jest liczbą elektronów biorących udział w elektrolizie. Zwykle n odpowiada ładunkowi jonu. Z praktycznego punktu widzenia ważny jest związek między masą substancji a przyłożonym prądem, co umożliwia sterowanie procesem poprzez zmianę jego siły.
Elektroliza stopu
Jedną z opcji elektrolizy jest zastosowanie stopu jako elektrolitu. W tym przypadku w procesie elektrolizy biorą udział tylko jony stopione. Klasycznym przykładem jest elektroliza stopionej soli NaCl (Sól). Jony ujemne pędzą do anody, co oznacza, że uwalniany jest gaz (Cl). Redukcja metalu nastąpi na katodzie, tj. osadzanie czystego Na utworzonego z jonów dodatnich, które przyciągają nadmiar elektronów. Podobnie można otrzymać inne metale (K, Ca, Li itp.) z masakry odpowiednich soli.
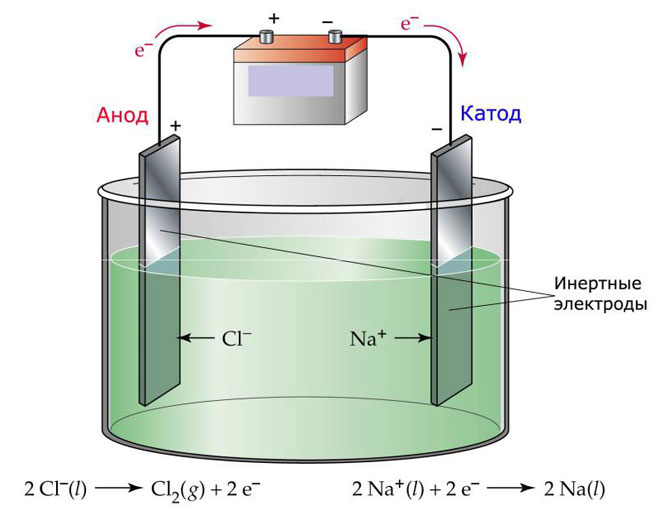
Podczas elektrolizy w stopie elektrody nie ulegają rozpuszczaniu, a uczestniczą jedynie jako źródło prądu. Do ich produkcji można użyć metalu, grafitu, niektórych półprzewodników. Ważne jest, aby materiał miał wystarczającą przewodność. Jednym z najpopularniejszych materiałów jest miedź.
Cechy elektrolizy w roztworach
Elektroliza w roztworze wodnym znacznie różni się od stopu. Zachodzą tu trzy konkurujące ze sobą procesy: utlenianie wody z wydzielaniem tlenu, utlenianie anionów i anodowe rozpuszczanie metalu. W procesie biorą udział jony wody, elektrolitu i anody.W związku z tym na katodzie może zachodzić redukcja wodoru, kationów elektrolitu i metalu anodowego.

Możliwość wystąpienia tych konkurencyjnych procesów zależy od wielkości potencjałów elektrycznych układu. Tylko proces, który wymaga mniej energii zewnętrznej, będzie postępował. W konsekwencji kationy o maksymalnym potencjale elektrody zostaną zredukowane na katodzie, a aniony o najniższym potencjale zostaną utlenione na anodzie. Potencjał elektrody wodoru jest przyjmowany jako „0”. Na przykład dla potasu jest to (-2,93V), sód - (-2,71V), Ołów (-0,13V), podczas gdy srebro ma (+0,8 V).
Elektroliza w gazach
Gaz może pełnić rolę elektrolitu tylko w obecności jonizatora. W takim przypadku prąd przepływający przez zjonizowany ośrodek powoduje niezbędny proces na elektrodach. Jednak prawa Faradaya nie mają zastosowania do elektrolizy gazu. Do jego realizacji niezbędne są następujące warunki:
- Bez sztucznej jonizacji gazu nie pomoże ani wysokie napięcie, ani duży prąd.
- Do elektrolizy nadają się tylko kwasy, które nie zawierają tlenu i są w stanie gazowym, a niektóre gazy nadają się do elektrolizy.
Ważny! Po spełnieniu niezbędnych warunków proces przebiega podobnie jak elektroliza w ciekłym elektrolicie.
Cechy procesów zachodzących na katodzie i anodzie
Dla praktycznego zastosowania elektrolizy ważne jest zrozumienie, co dzieje się na obu elektrodach po przyłożeniu prądu elektrycznego. Typowe procesy to:
- Katoda. Pędzą do niego dodatnio naładowane jony. Tutaj następuje redukcja metali lub wydzielanie wodoru. Istnieje kilka kategorii metali według aktywności kationowej.Metale takie jak Li, K, Ba, St, Ca, Na, Mg, Be, Al są dobrze redukowane tylko ze stopionych soli. Jeśli używany jest roztwór, wodór jest uwalniany w wyniku elektrolizy wody. Możliwe jest osiągnięcie redukcji w roztworze, ale przy wystarczającym stężeniu kationów, dla następujących metali - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Proces przebiega najłatwiej dla Ag, Cu, Bi, Pt, Au, Hg.
- Anoda. Do tej elektrody przedostają się jony naładowane ujemnie. Utlenione pobierają elektrony z metalu, co prowadzi do ich anodowego rozpuszczenia, tj. przejście w dodatnio naładowane jony, które są wysyłane do katody. Aniony są również klasyfikowane według ich aktywności. Takie aniony PO4, CO3, SO4, NO3, NO2, ClO4, F mogą być odprowadzane tylko z roztopów.W roztworach wodnych to nie one ulegają elektrolizie, ale woda z uwolnieniem tlenu. Najłatwiej reagują aniony takie jak OH, Cl, I, S, Br.

Przy zapewnieniu elektrolizy ważne jest uwzględnienie tendencji materiału elektrody do utleniania. Pod tym względem wyróżniają się anody obojętne i aktywne. Elektrody obojętne wykonane są z grafitu, węgla lub platyny i nie biorą udziału w dostawie jonów.
Czynniki wpływające na proces elektrolizy
Proces elektrolizy zależy od następujących czynników:
- Skład elektrolitów. Różne zanieczyszczenia mają znaczący wpływ. Dzielą się na 3 rodzaje - kationy, aniony i substancje organiczne. Substancje mogą być mniej lub bardziej ujemne niż metal nieszlachetny, co zakłóca proces. Wśród zanieczyszczeń organicznych wyróżniają się zanieczyszczenia (np. oleje) oraz środki powierzchniowo czynne. Ich stężenie ma maksymalne dopuszczalne wartości.
- gęstość prądu. Zgodnie z prawami Faradaya masa osadzonej substancji wzrasta wraz ze wzrostem natężenia prądu. Powstają jednak niekorzystne okoliczności - skoncentrowana polaryzacja, podwyższone napięcie, intensywne nagrzewanie się elektrolitu. Mając to na uwadze, dla każdego konkretnego przypadku istnieją optymalne wartości gęstości prądu.
- pH elektrolitu. Kwasowość środowiska jest również dobierana z uwzględnieniem metali. Na przykład optymalna wartość kwasowości elektrolitu dla cynku wynosi 140 g/m3.dm.
- Temperatura elektrolitu. Ma niejednoznaczny efekt. Wraz ze wzrostem temperatury wzrasta szybkość elektrolizy, ale wzrasta również aktywność zanieczyszczeń. Dla każdego procesu istnieje optymalna temperatura. Zwykle mieści się w przedziale 38-45 stopni.
Ważny! Elektrolizę można przyspieszyć lub spowolnić różnymi wpływami i doborem składu elektrolitu. Każda aplikacja ma swój własny schemat, którego należy ściśle przestrzegać.
Gdzie jest stosowana elektroliza?
Elektrolizę stosuje się w wielu dziedzinach. Istnieje kilka głównych obszarów zastosowania do uzyskania praktycznych wyników.
Galwanotechnika
Cienką, trwałą powłokę metalową można nakładać metodą elektrolizy. Powlekany produkt jest instalowany w kąpieli w postaci katody, a elektrolit zawiera sól żądanego metalu. Możesz więc pokryć stal cynkiem, chromem lub cyną.

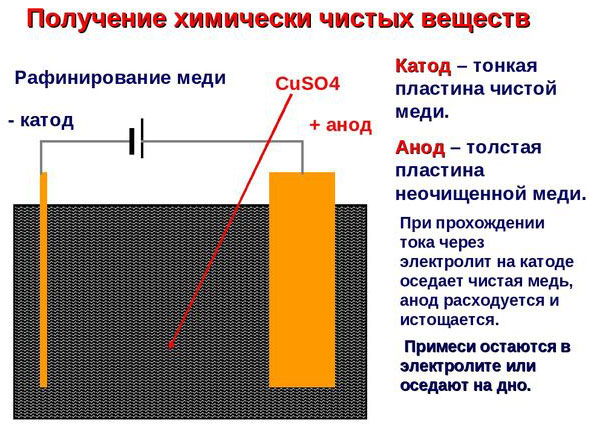
Elektrorafinacja - rafinacja miedzi
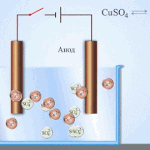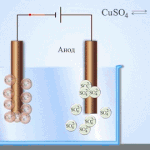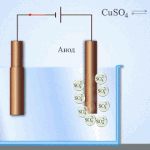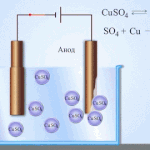
Przykładem czyszczenia elektrycznego może być następująca opcja: katoda - czysta miedź anoda - miedź z zanieczyszczeniami, elektrolit - wodny roztwór siarczanu miedzi. Miedź z anody przechodzi w jony i osadza się w katodzie już bez zanieczyszczeń.
Wydobycie metali
Aby uzyskać metale z soli, przenosi się je do wytopu, a następnie zapewnia w nim elektrolizę. Taka metoda jest dość skuteczna przy otrzymywaniu aluminium z boksytów, sodu i potasu.

Anodowanie
W tym procesie powłoka jest wykonana ze związków niemetalicznych. Klasycznym przykładem jest anodowanie aluminium. Część aluminiowa jest instalowana jako anoda. Elektrolit jest roztworem kwasu siarkowego. W wyniku elektrolizy na anodzie osadza się warstwa tlenku glinu, która ma właściwości ochronne i dekoracyjne. Technologie te znajdują szerokie zastosowanie w różnych gałęziach przemysłu. Możesz przeprowadzić procesy własnymi rękami zgodnie z przepisami bezpieczeństwa.
Koszty energii
Elektroliza wymaga wysokich kosztów energii. Proces będzie miał wartość praktyczną, jeśli prąd anodowy będzie wystarczający, a do tego konieczne jest doprowadzenie znacznego prądu stałego ze źródła zasilania. Ponadto podczas jego wykonywania występują straty napięcia bocznego - przepięcie anody i katody, straty w elektrolicie z powodu jego rezystancji. Sprawność instalacji określa się odnosząc moc zużywanej energii do jednostki masy użytkowej otrzymanej substancji.
Elektroliza jest stosowana w przemyśle od dawna iz dużą wydajnością. Powłoki anodowane i galwaniczne stały się powszechne w życiu codziennym, a wydobycie i wzbogacanie materiałów pomaga wydobywać wiele metali z rudy. Proces można zaplanować i obliczyć, znając jego główne wzorce.
Podobne artykuły: